Home Page| English Page|What's New | Recent Publications | Staff, Members, and OB/OGs |Research Activities |
Seminar Schedule, etc | BBS |Call for Graduate Students | J. Mol. Catal. B: Enzymatic| Links|
(1)アミノ酸脱水素酵素に関する研究(詳細を見る)
(2)D-アミノ酸アミド加水分解酵素に関する研究
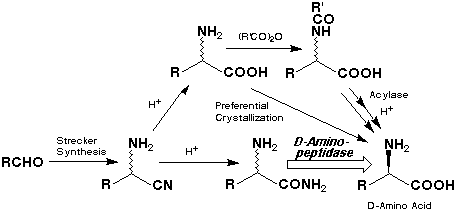
D-アミノ酸アミド加水分解酵素の反応中間体として想定されるD-アミノアシル-酵素複合体が加水分解されれば、D-アミノ酸が生成する。水よりも求核性の高い有機アミンがこれを脱アシル化すればD-アミノ酸を含む新たなペプチド結合が生成される。一方、下図のように、そのような酵素が存在すれば、ストレッカー法で安価に合成可能なラセミ体のアミノ酸アミドを不斉加水分解してD-アミノ酸を与える、新しい酵素的合成法にも発展できる。この合成では、アミノアシラーゼを用いるアシルアミノ酸の光学分割よりも短い3ステップでD-アミノ酸に到達できることになる。しかしながら、そのような酵素は従来知られていなかった。我々は、このような背景から、D-アミノ酸アミドの選択的な加水分解反応を触媒する未知の酵素をスクリーニングにより得ることを計画した。
D-アミノペプチダーゼ(Ochrobactrum anthropi)、アルカリD-ペプチダーゼ(Bacillus cereus)、D-アミノ酸アミダーゼ(O. anthropi)の新規なD-立体特異的なペプチドやアミノ酸アミド加水分解酵素のスクリーニング、酵素化学的諸性質および反応機構の検討、一次構造の解析並びにD-アミノ酸含有ペプチドの酵素的合成への利用について研究してきた。これらの一群の酵素がβ-ラクタマーゼ等のペニシリン認識酵素との相同性を有することを発見した。これらの酵素の進化過程の考察やペニシリン系抗生物質の作用機作に関する新たな研究の展開を計っている。また、これらのD-立体特異的なペプチド加水分解酵素群をアミノ酸アミドの光学分割によるD-アミノ酸やD-アミノ酸オリゴマーの合成に利用している。また、進化分子工学的手法によりD-アミノ酸アミダーゼの熱安定性を向上させた。
2.1 D-アミノペプチダーゼ
集積培養法や馴養培養法を用いて、D-アミノ酸アミドを窒素源として生育する多数の微生物を分離した。候補株からそのつど酵素を精製し、立体選択性を確認する二次スクリーニングを経て、数種の微生物株候補株を選択した。その結果、細菌Ochrobactrum anthropi SCRC C1-38 株を得た。D-アラニンアミドを基質としてD-アラニンを生成する酵素を、O. anthropi SCRC C1-38の無細胞抽出液より比活性で約2,800倍に精製した。本酵素は、分子量約 57,000のサブユニット 2個から成る分子量約115,000の蛋白である。本酵素の基質特異性を明らかにするために多数の基質を合成した。本酵素は、ペプチドを最も良好な基質とすること、およびペプチドのアミノ末端から加水分解する反応形式であることから、エキソペプチダーゼの一種であるアミノペプチダーゼであることが明らかである。また、基質のN末端がD-アミノ酸の立体を要求することから、新酵素「D-アミノペプチダーゼ」と命名した。D-アミノペプチダーゼには、酵素番号 (E.C. 3.4.11.19) が与えられている。
本酵素を高発現する大腸菌形質転換株を培養液と同じ菌体濃度とし、ラセミ体のアラニンアミド塩酸塩からのD-アラニン合成を行った。高濃度のアラニンアミド塩酸塩を、分割フィードせず、一度に反応液に加えて作用させたところ、短時間に定量的転換が実現できた。本酵素は、アミノ酸アミドに対する耐性が非常に高く、また、菌体によるラセミ化や、L-アラニンアミドの加水分解等の副反応も無いことが判明した。基質濃度5Mでは約4.5時間で定量的なD特異的加水分解が起こり、生成物濃度は、2.5M(約220g/liter)であった。
本酵素は、有機溶媒中では、D-アラニンメチルエステルの3-アミノペンタンによるアミノリシス反応を触媒し、D-アラニン3-アミノペンタンアミドを与えた。水飽和の酢酸ブチル、トリクロロエタンあるいはトルエン等の有機溶媒中に、ウレタン型プレポリマーPU-6で固定化した本酵素を触媒として加え、ラセミ体のアラニンエステルとアルキルアミンの縮合反応を行うと、D-アラニンアルキルアミドのみが定量的に得られた。更に固定化酵素を用いて各種のD-アミノ酸アミドを合成した。本法はアミノ基の保護を必要とせず、ラセミ体のアミノ酸エステルよりD体のアミノ酸アミドのみを選択的に合成出来る新しいアミド合成法である。
2.2 アルカリD-ペプチダーゼ
ところで、細菌の細胞壁には、あまり存在しない(D-Phe)4等に作用する酵素が存在すれば、どのような構造と機能を有するのだろうか。土壌を分離源とし、化学合成した(D-Phe)4を含むLB培地を用いて集積培養を行い、Bacillus cereus DF4-B株を分離した。(D-Phe)4加水分解酵素活性は培養液中に存在した。
合成基質を利用して、基質特異性を詳細に検討したところ、本酵素は比較的疎水性の高いD-アミノ酸ペプチドに特異的に作用するジペプチジルペプチダーゼ様エンドペプチダーゼであることがわかった。本酵素反応の至適pHは10.3周辺のアルカリ側にあったので、本酵素を「アルカリD-ペプチダーゼ」 (ADP, D-stereospecific peptide hydrolase (EC 3.4.11.-) ) と命名した。次に、本酵素遺伝子の大腸菌へのクローニングを行い、質量分析法を併用して、分子量約37,952のモノマー蛋白質であることを明らかにした。本酵素を用いて、D-Pheのオリゴマーの合成が可能である。
2.3 D-アミノ酸アミダーゼ
O. anthropi SCRC SV3株から精製した酵素は、D-フェニルアラニンアミド等の比較的かさ高いD-アミノ酸アミドに作用したが、D-アミノペプチダーゼ活性を示さなかった。本酵素は、「D-アミノ酸アミダーゼ」と呼ぶべき新しい酵素である。また、進化分子工学的手法によりD-アミノ酸アミダーゼの熱安定性を向上させた。わずかに、2ケ所の変異により酵素の熱安定性が約5℃上昇し、最大速度にも約2倍の向上が認められた。本酵素を高発現する大腸菌形質転換株を用いて、DL-フェニルアラニンアミドの光学分割を行い、約100g/literのD-フェニルアラニンを合成した。
(3)不飽和結合に作用する新規リアーゼに関する研究(詳細を見る)
(4)その他(詳細を見る)
研究の概要(目次、簡略) 研究の概要(総合、長文)