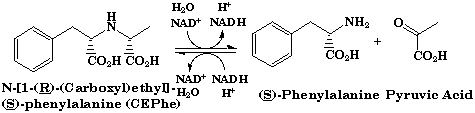Home Page| English Page|What's New | Recent Publications | Staff, Members, and OB/OGs |Research Activities |
Seminar Schedule, etc | BBS |Call for Graduate Students | J. Mol. Catal. B: Enzymatic| Links|
(1)アミノ酸脱水素酵素に関する研究
1.1 フェニルアラニン脱水素酵素
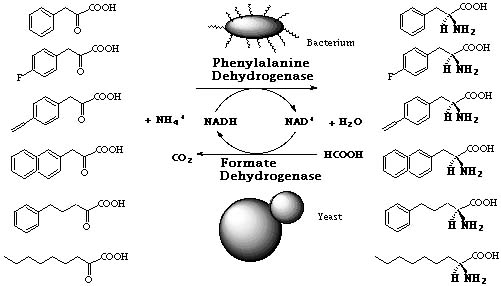
アミノ酸脱水素酵素に関する基礎的な知見の蓄積を広く行っている。フェニルアラニン脱水素酵素は、ドイツのKulaらが1984年にBrevibacterium 属細菌に活性を認めた新酵素である。我々は、独自にこの酵素の生産菌を広く微生物界にスクリーニングし、集積培養によって土壌より分離したSporosarcina ureae SCRC-R04、およびBacillus sphaericus SCRC-R79a、並びに保存菌のB. badius IAM 11059に本酵素活性を認めた。次に、本酵素を結晶状に単離し、その酵素化学的諸性質を初めて明らかにした。これらの酵素はいずれも分子量310,000〜360,000で、分子量39,000〜42,000の同等なサブユニット8個からなる。本酵素は、NAD+を補酵素とする酸化的脱アミノ化反応においてL-フェニルアラニンをはじめとする疎水的L-アミノ酸を基質とした。 我々の研究を基にして、フェニルアラニン脱水素酵素には、酵素番号(EC 1.4.1.20) が与えられた。
メタノール資化性酵母Candida boidiniiより精製した蟻酸脱水素酵素をNADHの再生用の酵素として本酵素と組み合わせて用い、蟻酸アンモニウムと触媒量のNAD+の存在下、各種のα-ケト酸から各種のL-アミノ酸を収率良く合成した。フェニルピルビン酸を基質として116g/literのL-フェニルアラニンを定量的に合成することができた。α-ケト酸の構造が基質として必須であることが明らかとなった。また、B. sphaericusの本酵素は、α-ケト酸の疎水性置換基の部分にはかなり立体的にかさ高い基質であっても受け入れることがわかった。アンジオテンシン変換酵素阻害剤エナラプリル等の構成成分であるL-ホモフェニルアラニンも収率良く合成できる。また、本酵素は13Nを用いてL-フェニルアラニン、L-チロシン、および L-DOPA 等を標識するのにも有効であり、代謝研究に利用することができる。
B. badiusの本酵素は、血液中のL-Pheの定量に有効であり、新生児フェニルケトン尿症のマススクリーニングの素子として1992年に厚生省の認可を受け、現在全国的に使用されており、新生児の約30%が本法で検査されている。
フェニルアラニン脱水素酵素を用いるL-アミノ酸の合成
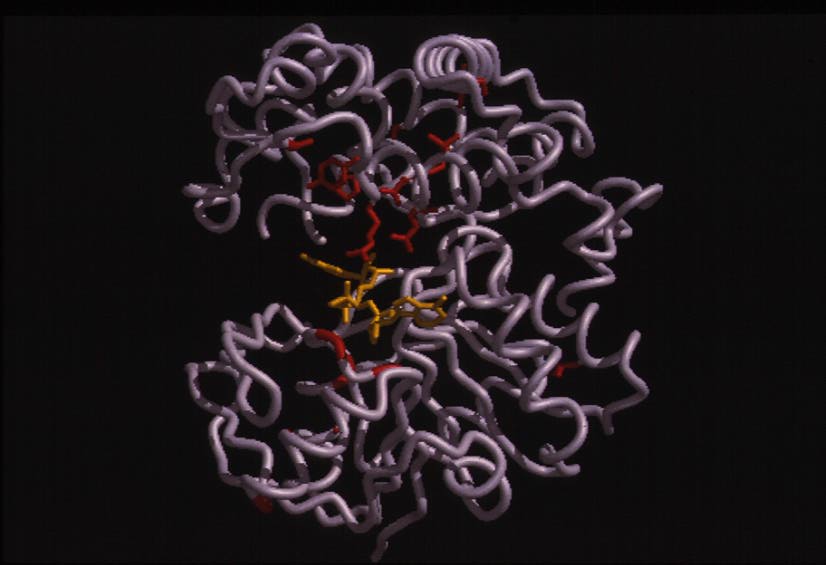
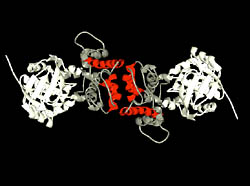
1.2 オピン脱水素酵素 土壌より分離したArthrobacter sp. 由来の新酵素オピン脱水素酵素は、分子量約36,000のホモダイマーであり、NAD+を補酵素とし、オピンに作用してL-アミノ酸とα-ケト酸を生成する酸化還元酵素である。L-アミノ酸部分は、比較的疎水性の高いL-アミノ酸を基質とし、α-ケト酸部分は、ピルビン酸、α-ケトグルタール酸、オキザロ酢酸、α-ケト酪酸を基質とする。詳細な基質特異性の検討の結果、本酵素をN-[1-D-(carboxyl)ethyl]-L-norvaline: NAD+ oxidoreductase (L-norvaline-forming: EC 1.5.1.-, オピン脱水素酵素(ODH))と命名した。最近、英国Sheffield大学、Rice教授との共同研究で、本酵素のX-線結晶構造解析に成功し1.8Å分解能における立体構造を明らかにした。本酵素の結晶は、斜方晶系に属し、空間群はP21212であった。本酵素は大きく2つのドメインからなり、2つのドメインの裂け目のうち、N-末端側のヌクレオチド結合部位にNAD+が結合していた。得られた高次構造の結果をもとにした、本酵素の反応機構の解明および機能改変について検討を進めている。
オピン脱水素酵素が触媒する反応
(2)D-アミノ酸アミド加水分解酵素に関する研究(詳細を見る)
(3)不飽和結合に作用する新規リアーゼに関する研究(詳細を見る)
(4)その他(詳細を見る)
研究の概要(目次、簡略) 研究の概要(総合、長文)